Unidad 2
Unidad 2
Introducción
Todo
lo que nos rodea, nuestro mundo, contiene objetos tales como árboles,
montañas, libros, diferentes tipos de construcciones casas, puentes,
edificios, postes, muebles, etc., a los determinados cuerpos.
Estos
cuerpos, pueden sufrir cambios, transformaciones, que nos estudiadas
por las Ciencias Naturales como la Biología. la Física, la Química...
Todos
ellos, los cuerpos, tienen un componente común, que es la materia.
Ocupan un lugar en el espacio (tiene volumen) y tiene masa.
Los
cuerpos están formados por diferentes tipo de materiales, y la química
es la Ciencia que se ocupa de la composición, propiedades y
transformaciones de los materiales. La Química no se ocupa de la forma
de los cuerpos, o del tamaño, sino de su composición, es decir, estudia e
investiga "que" materiales tienen un cuerpo (que = calidad, tipo,
clase), y "cuanto" hay de cada material (cuanto = cantidad). De modo
que. para una clasificación a prima facies de la Química, podríamos
dividirla en Química Cualitativa y Química Cuantitativa.
Los
cuerpos, además de materia, posee energía, y la Química también se
ocupa de los cambios energéticos que se verifican cuando ocurren
transformaciones en la materia.
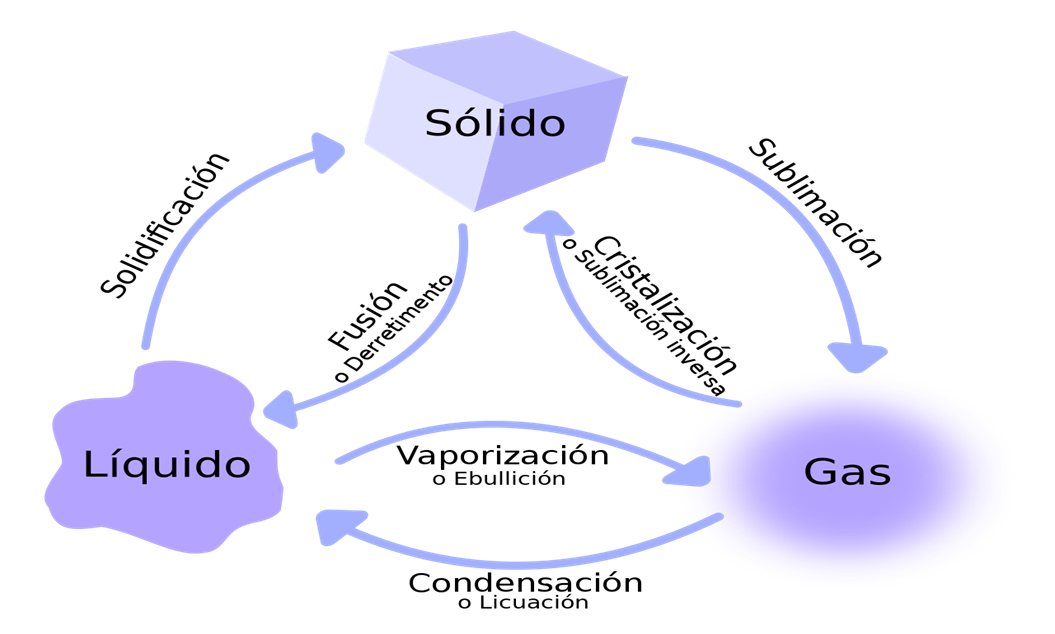
Estado de Agregación de la Materia
Los
materiales se presentan ante nosotros (principalmente) en tres estado
físico distintos, a los que denominamos estados de agregación. Ellos son
el sólido, el líquido y el gaseoso. En el agua, a modo de ejemplo,
podemos ver a diario los tres estados (aunque particularmente el estado
gaseoso del agua se llama vapor), y vemos también que se producen
cambios en el estado de agregación. Cada uno de estos cambios de estado
se expresa de un modo particular, y tiene un nombre específico. Para
ello, vemos el siguiente cuadro:



Estados de la materia
La materia se clasifica en tres estados.
En el estado solido las sustancias son rígidas y tienen forma definida. El volumen de los mismos no varía en forma considerable con cambios de temperatura.
En el estado solido las sustancias son rígidas y tienen forma definida. El volumen de los mismos no varía en forma considerable con cambios de temperatura.
En
los sólidos denominados cristalinos, ocupan posiciones definidas en
la estructura. Las fuerzas de interacción entre las partículas
individuales determinan la dureza y la resistencia del cristal.

En estado líquido las partículas individuales están confinadas en
un volumen dado. Los líquidos fluyen y toman la forma del recipiente
que los contiene. Es muy difícil comprimir líquidos.

Un ejemplo común es el agua.
Los Gases son
menos densos que los líquidos y los sólidos, y ocupan todo el
recipiente que los contiene; pueden expandirse hasta el infinito y se
comprimen con facilidad. Se concluye que los gases consisten
principalmente de espacio vacío; esto es, las partículas individuales
están bastante separadas.

El plasma materia
gaseosa fuertemente ionizada con igual número
de cargas eléctricas positivas y negativas (iones +/-) (electrones-).
Nombrado así plasma por primera vez en 1920 Irving Langmuir. (Tanarro)
La El plasma se obtiene al inducir a un gas a alta temperatura, o a una
gran voltaje. Son múltiples sus usos como Propulsores espaciales, Tv
y fusión nuclear.

Separaciones
Las mezclas de elementos rara vez se
encuentran en la naturaleza en forma pura, o casi puras, por lo
que es necesario separarlos en las mezclas en las que se
encuentran. Cuando se prepara un compuesto en el laboratorio, se
requieren de varios pasos para separarlos en forma pura de la
mezcla de reacción donde se formó. A
continuación se describen algunos métodos para
separar las sustancias puras de la mezcla:
- Filtración
La filtración es el proceso para separar los
sólidos que se encuentran suspendidos en líquidos
al pasar la mezcla a través de un embudo de
filtración; cuando el líquido atraviesa el filtro,
las partículas se retienen en él.
- Destilación
Un líquido que se vaporiza fácilmente se
le llama líquido volátil. La destilación es
el método por el cual se puede separar en sus componentes
una mezcla que contenga sustancias volátiles. Por ejemplo,
si se calienta una solución salina, el agua, que es el
componente más volátil, se evapora dejando
atrás la sal sólida.
- Tamización
El tamizado es uno de los métodos de
separación de mezclas, el cual consiste que mediante un
tamiz , zarandas o cernidores (redes de mallas más o menos
gruesas o finas) se separan partículas sólidas
según su tamaño.
Conclusión
Estado Sólido: podemos ver que los átomos se hallan dispuestos en un volumen pequeño, se sitúan adyacentes, uno al lado del otro, aunque no en contacto, formando generalmente una estructura.
Estado Líquido: los átomos se encuentran esparcidos en un volumen mayor, sin seguir ninguna estructura. La separación entre cada átomo es mayor que en el sólido.
Estado Gaseoso: los átomos ocupan un volumen mucho mayor. Es el estado en que los átomos están más separados.
Una explicación de cómo se forma el CBE es teniendo en cuenta que la
temperatura de un sistema es una medida del movimiento de sus átomos.
Explicas bien los conceptos, buen trabajo.
ResponderBorrar