Unidad 3
Unidad 3
Introducción
El estudio de los elementos químicos no es algo reciente, ciertos de años de investigación y experimentos han logrado crear una base confiable que, en la actualidad, nos permite interpretar el comportamiento de los elementos, saber lograrlos y clasificarlos según la tabla moderna, entre muchas otras cosas.
Elementos químicos y su clasificación
Sabemos que la materia esta formada por los elementos que se ubican en la tabla periódica, la cual surge de largos y arduos trabajos de grandes científicos que se decidieron a analizar dichos elementos y clasificarlos de acuerdo a sus propiedades.
Desde Johann Dobereiner y John Newlands con las ideas de las "triadas" y la "Ley de las Octavas; pasando por Dimitri Mendelejev y Lothar Meyer, hasta Henry Mosseley; todos y cada uno de ellos aportaron algo al desarrollo y perfeccionamiento de la tabla periódica, hasta llegar a la versión moderna en la que los elementos se encuentran organizados en orden ascendiente de acuerdo a sus números atómicos, con una distribución en filas horizontales, conocidas como Períodos y columnas verticales, llamadas grupos.
Tabla Periódica
La tabla periódica de los elementos, se denomina el esquema según el cual se clasifican, organizan y distribuyen los elementos químicos según sus propiedades y características.
En este sentido, la tabla periódica es una herramienta fundamental para el estudio de la química, pues permite identificar, de una manera coherente y fácil de entender, las diferencias y similitudes entre los diferentes elementos.
Las tablas periódicas sueles contener datos relativos a cada uno de los elementos existentes en ella, como lo son el símbolo, nombre, número atómico y masa atómica.
El desarrollo de la tabla periódica a lo largo de la historia esta estrechamente vinculado con el descubrimiento de los elementos y el estudio de sus propiedades comunes. Así mismo, aspectos como la noción de la masa atómica y las relaciones entre la masa atómica y las propiedades periódicas de los elementos han resultado fundamentales para configurar la tabla periódica moderna.
Como tal, se atribuye su creación al confitico ruso Dimitri Mendeléyev, quien en 1869 reunió en una tabla los 63 elementos hasta el momento conocidos por la ciencia. Por su lado, poco después, el químico alemán Julius Lothar Meyer los ordeno a partir de las propiedades físicas de los átomos. finalmente, su estructura actual se la debemos al científico suizo Alfred Werner.
Los últimos cambios importantes en la tabla periódica son obras del trabajo del premio Nobel de Química Glenn Seaborg, quien, entre otras cosas, ordeno la serio de los actinidos debajo de la serie de los lantánidos.
Como se está organizada
Las tablas periódicas se organizan en siete filas horizontales, conocidas como periodos, y dieciocho filas verticales, llamadas grupos.
Las filas horizontales o periodos ordenan los elementos según las capas electrónicas que este contenga, que se disponen de manera creciente, de izquierda a derecha y de arriba a abajo en la tabla. Así, cada elemento se coloca según su configuración electrónica. Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p d y f.
Por su parte, los elementos que forman parte de un mismo grupo tienen la misma valencia, esto quiere decir que posee el mismo número de electrones en la última capa y que tienen propiedades similares entre sí.
GRUPOS
Tabla periódica larga
Tabla Periódica
La tabla periódica de los elementos, se denomina el esquema según el cual se clasifican, organizan y distribuyen los elementos químicos según sus propiedades y características.
En este sentido, la tabla periódica es una herramienta fundamental para el estudio de la química, pues permite identificar, de una manera coherente y fácil de entender, las diferencias y similitudes entre los diferentes elementos.
Las tablas periódicas sueles contener datos relativos a cada uno de los elementos existentes en ella, como lo son el símbolo, nombre, número atómico y masa atómica.
El desarrollo de la tabla periódica a lo largo de la historia esta estrechamente vinculado con el descubrimiento de los elementos y el estudio de sus propiedades comunes. Así mismo, aspectos como la noción de la masa atómica y las relaciones entre la masa atómica y las propiedades periódicas de los elementos han resultado fundamentales para configurar la tabla periódica moderna.
Como tal, se atribuye su creación al confitico ruso Dimitri Mendeléyev, quien en 1869 reunió en una tabla los 63 elementos hasta el momento conocidos por la ciencia. Por su lado, poco después, el químico alemán Julius Lothar Meyer los ordeno a partir de las propiedades físicas de los átomos. finalmente, su estructura actual se la debemos al científico suizo Alfred Werner.
Los últimos cambios importantes en la tabla periódica son obras del trabajo del premio Nobel de Química Glenn Seaborg, quien, entre otras cosas, ordeno la serio de los actinidos debajo de la serie de los lantánidos.
Como se está organizada
Las tablas periódicas se organizan en siete filas horizontales, conocidas como periodos, y dieciocho filas verticales, llamadas grupos.
Las filas horizontales o periodos ordenan los elementos según las capas electrónicas que este contenga, que se disponen de manera creciente, de izquierda a derecha y de arriba a abajo en la tabla. Así, cada elemento se coloca según su configuración electrónica. Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p d y f.
Por su parte, los elementos que forman parte de un mismo grupo tienen la misma valencia, esto quiere decir que posee el mismo número de electrones en la última capa y que tienen propiedades similares entre sí.
GRUPOS
- Grupo 1 (I A): Metales alcalinos.
- Grupo 2 (II A): Metales alcalino térreos.
- Grupo 3 (III B): Familia de escandió.
- Grupo 4 (IV B): Familia del titanio.
- Grupo 5 (V B): Familia del vanadio.
- Grupo 6 (VI B): Familia del cromo.
- Grupo 7 (VII B): Familia del manganeso.
- Grupo 8 (VIII B): Familia del hierro.
- Grupo 9 (VIII B): Familia del cobalto.
- Grupo 10 (VIII B): Familia del níquel.
- Grupo 11 (I B): Familia del cobre.
- Grupo 12 (II B): Familia del zinc.
- Grupo 13 (III A): Térreos.
- Grupo 14 (IV A): Carbonoideos.
- Grupo 15 (V A): Nitrogenoideos.
- Grupo 16 (VI A): Calcógenos o anfígenos.
- Grupo 17 (VII A): Halógenos.
- Grupo 18 (VIII A): Gases nobles.
Tabla periódica larga
En 1913 Henry Moseley basándose en experimentos con rayos x determino los números atómicos de los elementos y con estos creó una nueva organización para los mismos.
En 1914 Glenn Seaborg Propone la serie de los actínidos dando origen a la tabla periódica larga.
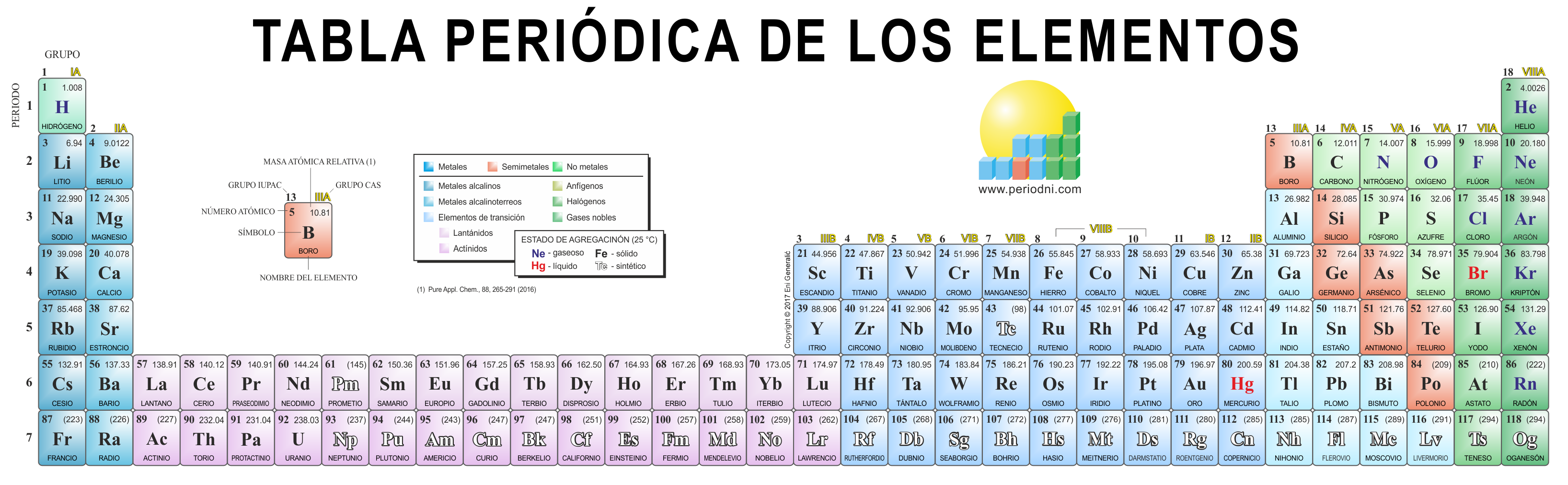
Tabla Cuantica

Tabla Cuantica
Esta tabla no se fija en las propiedades experimentales afines, sino en que los elementos que se encuentra en la misma columna tengan la misma configuración electrónica externa. Su construcción se basa en la asignar al electrón más externo de cada átomo los cuatro números cuánticos correspondientes a la configuración de mínima energía.
Al igual que en la tabla periódica, en la cuántica los elementos están agrupados en periodos y familias.
Tiene ocho periodos ubicados horizontalmente y señalados en la parte izquierda. Estos son el resultado de la suma de los valores de n + I que presenta los elementos.
Elementos de importancia economica
Elementos de importancia economica
- Aluminio - Construcción de aviones, vehículos y utensilios domésticos
- Antimonio - Metales de imprenta, textiles y baterías.
- Boro - Orgánicos síntesis de colorantes industriales, inorgánicos en blanqueo de tejidos y fotografías de bromuro de plata.
- Carbono - Componente de combustible como petroleo y gas natural.
- Cloro - Plástico disolvente, pesticidas, productos farmacéuticos, refrigerantes, colorantes, en la desinfección y para blanquear textiles.
- Cobalto - Aceros especiales, herramientas mecánicas de alta velocidades, imanes y motores.
- Cobre - Conductor electrónico, elaboración de monedas y bronce.
- Flúor- El fluoruro de sodio en la fluoración del agua potable y en las pastas dentales.
- Hidrógeno - Es muy importante para la refinación del petróleo y amoniaco.
- Hierro - Acero, cemento, fundaciones de metales, y así como componente importante en la sangre.
- Mercurio - Instrumentos de presión, bacterias, termómetro, barómetros, amalgamas dentales, medicamentos e insecticidas.
- Oro - Empleado en joyería, ornamentos, piezas dentales y equipos científicos.
- Plata - Acuñaciones de moneda, manufacturación de vajillas, joyas, aparatos electrónicos, alación y soldaduras.
- Plomo - Fabricación de baterías, acumuladores, pinturas y soldaduras.
- Yodo - Productos farmacéuticos, pinturas, fotografías, en forma de yoduro de plata, y también como desinfectante.
- - Gases naturales - Al ser extraído constituyen un buen manantial de gasolina.
- Butano y Propano - Son utilizados como gases domésticos en las regiones donde no existe distribución de gas del alumbrado.
Elementos Contaminantes
En la naturaleza existen algunos elementos que debido a su estructura o en conminacion con otros en forma de compuestos, son perjudiciales para el hombre, algunos de estos elementos son:
- Antimonio - Provoca envenenamiento por ingestión o inhalación de vapores, principalmente por un gas llamado estibina SbH3.
- Arsènico - Es uno de los elementos màs venenosos que hay, asì los compuestos.
- Azufre (S) - Principalmente son óxidos SO2 y SO3 contaminan el aire y con agua, producen la lluvia ácida. El gas H25 es sumamente toxico y contamina el aire.
- Bromo (Br) - Sus vapores contaminan el aire, ademas sus compuestos derivados. Son lagrimosos y venenosos.
- Cadmio - Contamina el aire y el agua. Contenido en algunos fertilizantes contamina el suelo.
- Cloro - Contamina el aire y es corrosivo. Algunos compuestos órganizos clorados como insecticidas, analógicos y solventes dañan el hígado y el cerebro. Los medicamentos que contienen cloro afectan el sistema nervioso.
- Mercurio - Contamina el agua, y el aire y causa envenenamiento.
- Plomo - Contamina el aire proviene de las gasolinas para automóviles. Por su uso el organismo se afecta de saturnismo. Sus sales, como el acetato, son venenosas.
Conclusion
Mediante Las actividades realizadas conocimos la evolución de la tabla periódica que ha tenido a través del tiempo, aprendimos también que existen diferentes propiedades periódicas y también aprendimos la importancia y las características que tiene el elemento Plomo.
Explicas bien los conceptos, buen trabajo.
ResponderBorrarExcelente trabajoo :D
ResponderBorrarExcelente trabajo, sigan así
ResponderBorrar